Chimie 1
مخطط الموضوع
-
Enseignante : BOUKHATEM Horiya
Département : Sciences de la Matière
Unité d'enseignement : Fondamentale
Matière : Chimie 1
Coefficient : 03
Crédits : 06
Mode d’evaluation : Contrôle Continu : 33%, Examen : 67%
-
Chapitre 1: Notions fondamentales
Chapitre 2: principaux constituants de la matière
Chapitre 3 : Radioactivité – Réactions nucléaires
Chapitre 4 : Structure électronique de l’atome
Chapitre 5: Classification périodique des éléments
Chapitre 6 : Liaisons chimiques
-
- Définir les notions et les lois fondamentales.
- Mettre en évidence des principaux constituants de l'atome (proton, neutron et électron).
- Savoir les radioactivités naturelle et artificielle et leurs différents types.
- Déterminer la position de l’électron dans un espace de l’atome à l’aide des nombres quantiques.
- Savoir répartir les électrons d’un atome ou d’ion à l’aide de la règle de Klechkowski.
- Classifier les éléments chimiques dans le tableau périodique.
- Connaitre les différents types de liaisons chimiques.
-
Pour avancer dans ce cours, des connaissances mathématiques préalables sur les intégrales et les fonctions Logarithme et exponentielle sont nécessaires.
-
Le premier chapitre décrit :
- Les notions fondamentales de la structure de la matière (atome, molécule, corps, mélange, solution...)
- Les lois fondamentales (molarité, normalité, molalité, densité, masse volumique, fractions massique et molaire...).

-
Le deuxième chapitre est consacré à la :
- Mise en évidence des constituants de l'atome : proton, neutron et électron.
- Caractéristiques de l'atome (nombre de masse et numéro atomique).
- Définitions des isotopes, d'abondance relative et de la masse atomique.
- Détermination de l'énergie de liaison du noyau.

-
Le troisième chapitre est consacré à l'étude :
- des radioactivités naturelle et artificielle.
- des différents types de la radioactivité (fission, fusion, transmutation, α, β et γ).
- énergétique et cinétique des désintégrations radioactives.
- des applications et dangers de la radioactivité.

- des radioactivités naturelle et artificielle.
-
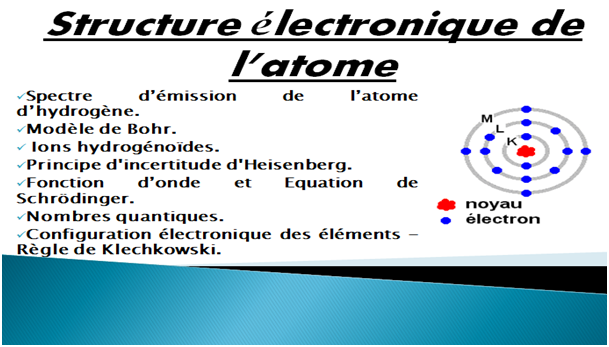
Le quatrième chapitre traite les modèles classique et ondulatoire de l’atome.
- Dans le modèle classique, on verra l'effet photoélectrique, le spectre d’émission de l'atome d’hydrogène, ions hydrogénoïdes et le modèle de Bohr.
- Dans le modèle ondulatoire, on abordera le principe d’incertitude d’Heisenberg, la fonction d'onde, l’équation de Schrödinger, les nombres quantiques, configuration électronique et la règle de Klechkowski.
-
Le cinquième chapitre représente :
- La description du tableau périodique (périodes, groupes/sous groupes, familles, blocs).
- L'évolution des propriétés physico-chimiques des éléments (rayon atomique, énergie d'ionisation, affinité électronique, électronégativité).

- La description du tableau périodique (périodes, groupes/sous groupes, familles, blocs).
-
Le sixième chapitre décrit :
- Les différents types de liaisons chimiques (liaison covalente, liaison de coordination, liaison ionique et liaison polarisée).
- Le diagramme de Lewis et moment dipolaire.
- La théorie des orbitales moléculaires (méthode CLAO).
- Le diagramme énergétique des molécules diatomiques homo-nucléaires et hétéro-nucléaires.
- La théorie d’hybridation des orbitales atomiques.
- Géométrie des molécules : théorie de Gillespie.

-
-
